Контрольна робота за 1 сесестр
піготовка
(завдання будуть подібні)
Урок 3-4
Діагностична контрольна робота
піготовка (завдання будуть подібні)
Варіант І
1. Дано ряд речовин: Назвіть ці речовини.
Ca(NO3)2 _____________________________________
H2SO4 ________________________________________
SiO2 __________________________________________
Al(OH)3 _______________________________________
CaО _________________________________________
FeSO4 _______________________________________
P2O5 ________________________________________
CaCO3 ______________________________________
H2CO3 ______________________________________
2. Виберіть із переліку речовини, розчини яких забарвлюють фенолфталеїн у малиновий колір:
1) NaOH; 2) Na2SO4; 3) HCl; 4) CaCO3.
3. Установіть відповідність:
а) кислотний оксид 1) SO3
б) основний оксид 2) Na2S
в) амфотерний оксид 3) CaО
г) не є оксидом 4) ZnО
4. Виберіть речовину, що не буде взаємодіяти із сульфатною кислотою:
а) Hg; б)Na2SO4; в)Zn; г)Cu(OH)2.
5. Виберіть ряд солей, розчини яких унаслідок у взаємодії з розчином NaOH утворюють виключно нерозчинні основи:
1) NaCl, CuCl2, MgCl2;
2) Al2(SO4)3, CuSO4, Na2SO4;
3) AlCl3, CuCl2, MgCl2.
6. Допишіть рівняння можливих реакцій:
1) CO2 +NaOH → 2) Cu + ZnSO4→
3) Na2SO4 +H2CO3 → 4) H2S+KOH→
7. Для нейтралізації хлоридної кислоти кількістю речовини 0,5 моль
необхідно взяти кальцій гідроксид кількістю речовини:
а) 0,5 моль; б) 0,25 моль; в) 1 моль; г) 1,5 моль.
8. Здійсніть перетворення: Ca→CaO→Ca(OH)2→CaCl2
9. До розчину арґентум нітрату додали 55г натрій хлориду. Яка маса осаду при цьому утвориться?
Варіант ІІ
1. Дано ряд речовин, Назвіть ці речовини.
KOH _________________________________
SO3 _________________________________
KNO3 _________________________________
HNO3 _________________________________
FeО _________________________________
Na2SO4 _________________________________
Al(OH)3 _________________________________
H3PO4 _________________________________
MgCl2 _________________________________
2. Виберіть із переліку речовини, розчини яких забарвлюють метиловий оранжевий у жовтий колір:
1) H2SO4; 2) H2CO3; 3) NaCl; 4) Ba(OH)2.
3. Установіть відповідність:
а) безоксигенова кислота 1) Cu(OH)2
б) оксигеновмісна кислота 2) HCl
в) сіль 3) Na2SO4
г) основа 4) H3PO4
4. Виберіть речовину, що не буде взаємодіяти із сульфатною кислотою:
а)SO2; б)Ag; в)Al; г)Al(OH)3.
5. Виберіть ряд, у якому всі оксиди внаслідок розчинення у воді утворюють луги:
1) Na2O, BaО, K2O;
2) Na2O, Cu2O, N2O;
3) CO, BaО, CaО.
6. Допишіть рівняння можливих реакцій:
1) Cu(OH)2+NaOH→ 2) Fe +CuSO4→
3) BaO+KOH→ 4) Zn +HCl→
7. Для нейтралізації сульфатної кислоти кількістю речовини 1 моль необхідно
взяти натрій гідроксид кількістю речовини:
а) 1 моль; б) 2 моль; в) 0,5 моль; г) 4 моль.
8. Здійсніть перетворення:
1) K2O→ KOH→ KNO3
2) KOH→K2SO4
9. До розчину сірчаної кислоти додали 33,6 г калій гідроксиду. Скільки грамів солі при цьому утворюється?
Урок 1-2
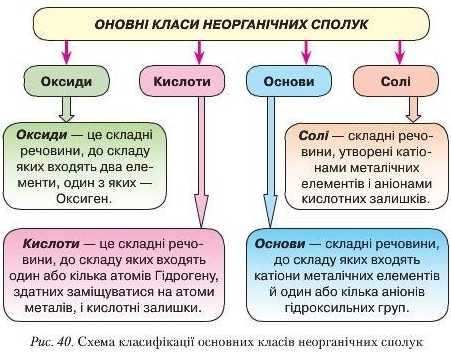
Тема: Склад і властивості основних класів неорганічних сполук.
матеріал для повторення:
ОКСИДИ- це складні речовини, що складаються з атомів двох хімічних елементів, один з яких Оксиген.
Основи - це складні речовини, які складаються з атомів металічного елемента та однієї або кількох гідроксогруп (ОН).
Кислоти - це складні речовини, які складаються з атомів Гідрогену, що можуть заміщуватися атомами металічних елементів, та кислотних залишків.
хімічні властивості
ДОМАШНЄ ЗАВДАННЯ: & 1 завд 5-12 ст10-11

2020-2021 навчальний рік
Усім доброго дня!
От і настав час підвести підсумок самостійного вивчення хімії.
Хочу побажати вам гарного настрою, удачі, і успішно виконати контрольну роботу.
Вітаю любих восьмикласників!
Звільнені від підсумкової контрольної роботи:
8-А Голікова Олена, Карьєв Єгор, Слаква Ігор, Сокол Ірина, Тяжкороб Лілія, Феделенчук Ярослав, Чубенко Дар'я
8-Б Васільєва Вікторія, Ковальчук Валерія, Соколенко Єгор, Тесленко Назар
8-В Адамов Володимир, Багнюк Євген, Бордюк Нікіта, Врублевська Любов, Мартисевич Данило, Мех Ірина, Одіжна Дар'я, Рибченко Анастасія, Щербак Кирило
8-Г Будко Анастасія, Дорогобід Катерина, Зубарєв Єгор, Кармазін Ростислав, Мироненко Єлизавета
Підсумкова контрольна робота
Тест має 26 питаннь. Питання мають одну або декілька правельних відповідей. В кінці тесту обовязково введіть своє прізвище. На всі завдання що потребують розвязків (рівняння реакції, задачі) ви присилаєте фотозвіти, якщо фотозвіти відсутні питання не зараховується і відповідно знімається бал оцінювання цього питання.
Час проведення: 10.00-20.00
БАЖАЮ УСПІХІВ
4 Тест з теми
"КИСЛОТИ"
Обов'язково пишемо своє призвіще в кінці тесту
3 Тест з теми
"ОСНОВИ"
Обов'язково пишемо своє призвіще в кінці тесту
2 Тест з теми
"ВЛАСТИВОСТІ ОКСИДІВ"
Обов'язково пишемо своє призвіще в кінці тесту
1 Тест з теми "ОКСИДИ"
26.03.2020
Любі мої діти карантин подовжено та ми займаємось дистанційно.
Пропоную вам подорож до країни неорганічних сполук. Відкрийте презентацію та виконайте вправи.
18.03.2020
Нова тема: СОЛІ
Перегляньте відео, зробіть конспек у зошит та виконайте завдання яке подано у відеоматеріалі,
надсилайте виконане завдання у вайбер або на пошту(фото).
БАЖАЮ УСПІХІВ!
Потренуйтеся на тренажері складання формул солей
↓
Повторення тем
Кислоти
Кислоти - це складні речовини, які складаються з атомів Гідрогену, що можуть заміщуватися атомами металічних елементів, та кислотних залишків.
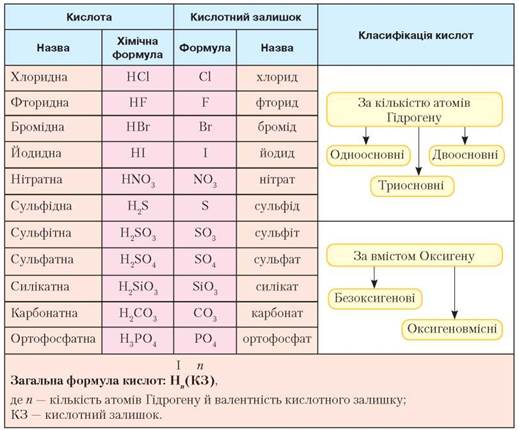
За вмістом атомів Оксигену кислоти поділяють на оксигеновмісні та безоксигенові.
До оксигеновмісних кислот належать сульфатна Н2SO4, нітратна HNO3 та ін. Оксигеновмісні кислоти є гідратами кислотних оксидів, тобто продуктами приєднання молекули води до молекули кислотного оксиду.
До безоксигенових кислот належать розчини деяких газів у воді. Наприклад, хлоридна кислота - це розчин газуватого хлороводню HCl у воді, флуоридна - розчин фтороводню HF, сульфідна - розчин сірководню H2S тощо.
За числом атомів Гідрогену. здатних заміщуватися на атоми металічного елемента (за основністю кислоти), кислоти поділяють на одноосновні (HCl, HNO3), двохосновні (H2S, H2SO4), трьохосновні (H3PO4) тощо.
За силою кислоти поділяють на сильні (HNO3, HI, HBr, HCl, H2SO4), кислоти середньої сили (H2SO3, H3PO4, HF, HNO2) та слабкі (H2CO3, H2S, H2SiO3).
Фізичні властивості кислот
Більшість кислот — рідини, наприклад нітратна HNO3 і сульфатна Н2SO4 кислоти. Деякі кислоти — тверді речовини, наприклад фосфатна Н3РО4 і боратна Н3ВО3 кислоти.
Більшість кислот добре розчинні у воді. Виняток — силікатна кислота H2SiO3, яка практично нерозчинна.
Водні розчини кислот відзначаються кислим смаком, руйнують рослинні і тваринні тканини
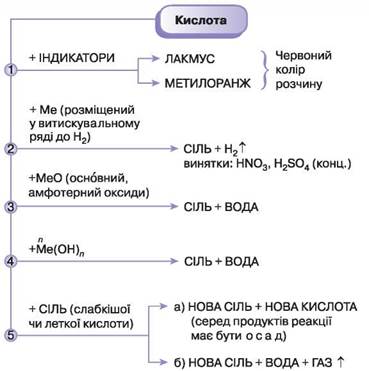
Хімічні властивості кислот
1. Кислоти змінюють забарвлення індикаторів:
2. Кислоти реагують з металами , які в ряду напруг металів розміщені до Н (усі крім Сu , Нg , Аg , Рt , Аu)
Zn + Н2SО4 = ZnSО4 + Н2
2Аl + 6НСl = 2АlСl3 + 3Н2
3. Кислоти реагують з оксидами металів
СuО + Н2SО4 = СuSО4 + Н2О
Fе2О3 + 6НСl = 2FеСl3 + 3Н2О
4. Кислоти реагують з основами ( реакція нейтралізації)
NаОН + НСl = NаСl + Н2О
Сu(ОН)2 + Н2SО4 = СuSО4 + 2 Н2О
5. Кислоти реагують з деякими солями , якщо в результаті реакції утворюється газ або осад СаСО3 + 2НСl = СаСl2 + Н2О + СО2
АgNО3 + НСl = АgСl + НNО3
Безпека під час роботи з кислотами
Кислоти належать до їдких речовин. При потраплянні кислот на шкіру або слизові оболонки з'являються хімічні опіки, а при потраплянні концентрованої сульфатної кислоти - навіть обуглювання шкіри. У разі потрапляння кислот на одяг з'являються дірки: відразу або після прання (залежно від кількості кислот). Тому з кислотами, особливо з концентрованими, треба поводитися дуже обережно. Працювати з ними бажано в гумових рукавичках. При розчиненні концентрованих кислот у воді виділяється велика кількість теплоти. Якщо наливати воду в склянку з концентрованою кислотою, то вода збирається на поверхні (густина концентрованих кислот більша) і під дією теплоти, що виділяється, може закипіти й почати розбризкуватися. Тому при розведенні концентрованих кислот слід обов'язково наливати тільки кислоту в склянку з водою, а не навпаки!
Основи
Основи - це складні речовини, які складаються з атомів металічного елемента та однієї або кількох гідроксогруп (ОН).
I
NaOH - натрій гідроксид
II
Ca(OH)2 - кальцій гідроксид
III
Al(OH)3 - алюміній гідроксид
IV
Ti(OH)4 - титан (IV) гідроксид
Розчинні у воді (луги)
|
Нерозчинні у воді
|
LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2
|
Al(OH)3, Fe(OH)2, Cr(OH)3 тощо
|
Амфотерні гідроксиди та відповідні їм кислоти й солі
Амфотерний оксид
|
Амфотерний гідроксид
|
Відповідна йому кислота
|
Кислотний залишок
|
Формула
|
назва
|
Формула
|
Назва
|
Формула й валентність
|
Назва
|
ZnO
|
Zn(OH)2
|
цинк гідроксид
|
H2ZnO2
|
Цинкатна
|
II
ZnO2
|
Цинкат
|
SnO
|
Sn(OH)2
|
станум(ІІ) гідроксид
|
H2SnO2
|
Станатна
|
II
SnO2
|
Станат
|
PbO
|
Pb(OH)2
|
плюмбум(ІІ) гідроксид
|
H2PbO2
|
Плюмбатна
|
II
PbO2
|
Плюмбат
|
Al2O3
|
Al(OH)3
|
алюміній гідроксид
|
H3AlO3
|
Алюмінатна
|
III
AlO3
|
Алюмінат
|
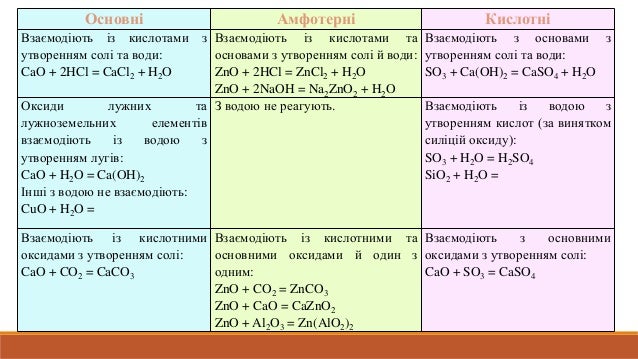
Хімічні властивості основ
Луги
|
Нерозчинні гідроксиди
|
Взаємодіють із кислотами з утворенням солі й води (реакція нейтралізації):
2КОН + H2SO4 = K2SO4 + 2H2O Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
|
Взаємодіють із кислотними оксидами:
2NaOH + CO2 = Na2CO3 + H2O
|
Взаємодіють із кислотними оксидами (ангідридами сильних кислот):
|
Взаємодіють з амфотерними оксидами й гідроксидами:
2NaOH + ZnO = Na2ZnO2 + H2O
KOH + Al(OH)3 = KAl(OH)4
|
Не взаємодіють
|
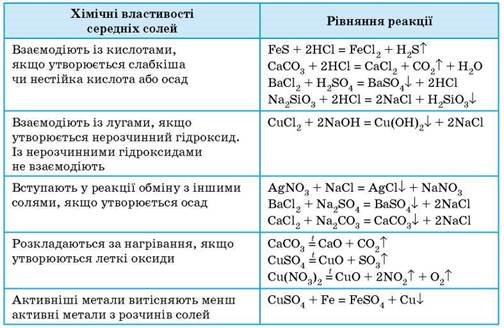
Взаємодіють із солями, якщо виконується хоча б одна умова протікання реакцій обміну:
2NaOH+CuSO = Cu(OH)2 + Na2SO4
NaOH+NaHCO3=Na2CO3+CO2+H2O
|
Не взаємодіють
|
Гідроксиди лужних металів стійкі до нагрівання, гідроксиди лужноземельних металів розкладаються, але при більш високій температурі, ніж нерозчинні гідроксиди:
Ca(OH)2 = CaO + H2O
|
При нагріванні розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
|
Безпека під час роботи з основами
Луги є їдкими речовинами: вони роз'їдають шкіру, дерево, папір, можуть бути причиною серйозних опіків шкіри та слизових оболонок. Недарма натрій гідроксид називають їдким натром. а калій гідроксид - їдким калі. Вовняна тканина, занурена в концентрований розчин натрій гдроксиду, набухає й перетворюється на драглеподібну масу. Якщо розчин лугу, котрий потрапив на руку, не змити водорю, шкіру почанає щипати, і незабаром утворюється виразка.
Працюючи з лугами, слід одягати захисні окуляри, оскільки потрапляння лугів в очі є вкрай небезпечним. Якщо луг випадково потрапив на шкіру, його треба негайно змити великою кількістю проточної води, а потім, у разі потреби, протерти ушкоджену ділянку шкіри слабким розчином боратної або етанової кислоти.
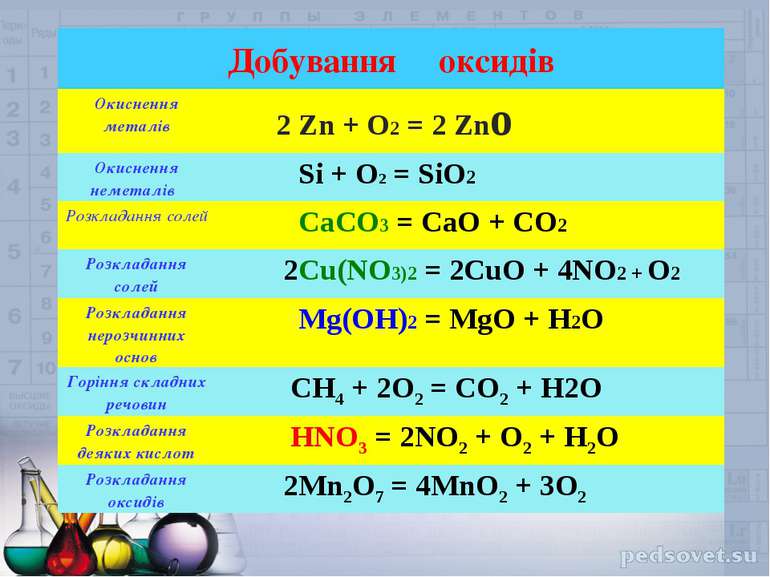
Оксиди
Оксиди - це складні речовини, що складаються з атомів двох хімічних елементів, один з яких Оксиген.
Оксиди поділяють на чотири групи: кислотні, основні, амфотерні та несолетворні.
Кислотні:
більшість кислотних оксидів - це оксиди неметалічних елементів. Але кислотні оксиди здатні утворювати й металічні елементи, якщо ці елементи можуть виявляти дуже високі валентності, вищі аніж 4. так, до кислотних оксидів належать CrO3, Mn2O7.
Кислотні оксиди ще називають ангідридами кислот. Слово "ангідрид" буквально означає безводнена кислота. Слово "ангідрид" та "кислотний оксид" - синоніми. Кожний оксигеновмісній кислоті відповідає кислотний оксид.
Кислоти й відповідні ангідриди
Кислоти
|
Кислотний оксид (ангідрид)
|
H2SiO3
|
SiO2
|
H2SO4
|
SO3
|
H3PO4
|
P2O5
|
HClO4
|
Cl2O7
|
H2CrO4
|
CrO3
|
HMnO4
|
Mn2O7
|
Основні:
оксиди, яким відповідають основи, називають основними оксидами.
До основних оксидів належать оксиди металічних елементів. це, як правило, оксиди одно-, дво- і тривалентних металів.
Більшість основних оксидів із водою не взаємодіють. У реакцію з водою вступають лише ті оксиди, яким відповідають луги.
Na2O + H2O = 2NaOH (Na2O∙H2O)
BaO + H2O = Ba(OH)2 (BaO∙H2O)
Основні оксиди й відповідні основи
Основні оксиди
|
Відношення до води
|
Основи
|
Na2O
|
Взаємодіють із водою
|
NaOH
|
K2O
|
KOH
|
SrO
|
Sr(OH)2
|
BaO
|
Ba(OH)2
|
Ag2O
|
Не взаємодіють із водою
|
AgOH
|
СuO
|
Cu(OH)2
|
FeO
|
Fe(OH)2
|
Амфотерні:
речовини, які можуть виявляти кислотні й основні властивості залежно від сполуки, з якою вони взаємодіють, називаються амфотерними.
Амфотерність виявляють оксиди й гідроксиди деяких хімічних елементів із валентностями ІІ, ІІІ й ІV. найважливіші серед них - Берилій (ІІ), Цинк (ІІ), Станум (ІІ), Плюмбум (ІІ), Алюміній (ІІІ), Хром (ІІІ), Титан (ІV).
Несолетворні:
відомі оксиди, яким не відповідає ані кислота, ані основа їх називають несолетворними. До них належать карбон (ІІ) оксид СО, нітроген (ІІ) оксид NO, нітроген (І) оксид N2O та деякі інші. Вони являють собою гази, малорозчинні у воді, і не вступають із нею в хімічні реакції. Усі інші оксиди (кислотні й основні) називають солетворними.










Немає коментарів:
Дописати коментар